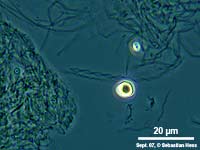
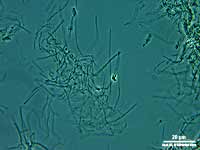
Einige Bakterien haben einen großen Anteil an der Eisenoxidation in Gewässern und leben von der Energie der Oxidation von Fe2+ zu Fe3+. Das eisenoxidierende Bakterium Gallionella spec. zum Beispiel kommt immer mit Eisen assoziiert in vielen verschiedenen limnischen und auch marinen Habitaten vor. Es handelt sich dabei um ein mikroaerophiles Betaproteobakterium, welches stäbchen oder nierenförmige Zellen ohne (!) Peptidoglycan-Zellwand bildet. Trotz einer polar monotrichen Begeißelung scheinen die Baketrien zumindest zeitweilig sessil zu leben. Sie sezernieren an einer Seite des Zellkörpers einen proteinhaltigen, helical gewundenen Stiel von ca. 2 µm Breite, der seinerseits aus ca. 20 Mikrofibrillen aufgebaut ist (vgl. Abb). Diese Stiele sind mit oxidierten Eisenverbindungen inkrustiert und die Funktion der Stiele ist bis heute nicht geklärt.
Bei geringen Sauerstoffkonzentrationen oxidiert Gallionella gelöste Fe2+-Ionen zu Fe(III)-Verbindungen wie unlösliches und amorphes Fe(OH)3 oder FeO(OH). Solche Verbindungen wurden in Form von diskreten Partikeln rasterelektronenmikroskopisch auf den Stielen von Gallionella nachgewiesen, woraus wahrscheinlich die rotbraune Farbe der Gallionella-Populationen resultiert. Weiterhin ergaben Untersuchungen der Stiele mit der energie-dispersen Röntgen-Spektroskopie, dass auch andere Metallionen wie Silizium, Calcium und Aluminium auf den Stielen abgelagert werden. Nicht jedoch Mangan, welches ebenfalls häufig als Reduktionsmittel für bakterielle Atmungsvorgänge dient. Gallionella ist chemolithoautotroph und ist somit nicht auf organische Verbindungen aus der Umwelt angewiesen. Die Zellen assimilieren wie pflanzliche organismen CO2 mit dem Unterschied, dass die dafür benötigte Energie nicht von der Sonne (elektromagn. Strahlung namens Licht) sondern aus einem chemischen Oxidationsprozess stammt.
Gallionella habe ich in stehenden Gewässern eines Hangquellmoores gefunden, in denen das Bakterium dichte, gallertige Biomatten ausbildet. Vor langer Zeit, so habe ich herausgefunden, wurde in diesem Gebiet Eisen verhüttet, was auf einen eisenhaltigen Untergrund hindeutet und das Vorkommen von Gallionella verständlich macht. Das saure Milieu, Humin- und Fulvosäuren - durch Torfmoose produziert - und die große tote Biomasse mit entsprechendem O2-Verbrauch tragen sicherlich zur guten Löslichkeit von reduziertem Eisen (Fe2+) bei. Die Bakterien entwickeln sich massenhalft und überführen durch ihre anaerobe Atmungsaktivität das Eisen in die unlösliche rotbraune Form.
Auch in anthropogenen Habitaten wie eisenhaltigen Wasserleitungssystemen kann Gallionella massenhaft auftreten. Bevorzugt in alten, selten benutzten und dementsprechend sauerstoffarmen Leitungen entwickeln sich die Bakterien gut. Die aufgebaute Biomasse dient wiederum chemoorganotrophen Bakterien als Nahrungsgrundlage, die unter anoxischen Bedingungen organische Säuren und Schwefelwasserstoff produzieren können. Diese Stoffwechselprodukte sorgen neben dem Problem der Korrosion für ungenießbares Wasser.
Trotz alle dem ist Gallionella ein bemerkenswertes Bakterium, dessen grazile Hinterlassenschaften (die Stiele) in einigen Gewässerproben zu finden sind, während sich die mobilen Zellen abgelöst haben.




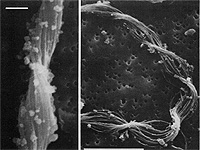
H. F. RIDGWAY, E. G. MEANS, AND B. H. OLSON: Iron Bacteria in Drinking-Water Distribution Systems: Elemental Analysis of Gallionella Stalks, Using X-Ray Energy-Dispersive Microanalysis