o Fang der Beutetiere
o Töten der Beutetiere
o Verdauen/Zersetzen der Beutetiere
o Resorption und Nutzung der entstandenen Nährstoffe

| o Anlocken der
Beutetiere o Fang der Beutetiere o Töten der Beutetiere o Verdauen/Zersetzen der Beutetiere o Resorption und Nutzung der entstandenen Nährstoffe |
 |
| Nepenthes maxima mit angelocktem Insekt |
 |
 |
 |
| P. purpurea am Naturstandort [Irland] | P. purpurea in Gesellschaft mit Sphagnum [Schottland] | Petrischalenkultur auf sterilem Quarz-Sand |
 |
 |
 |
| Pflanzen mit Vegetationsspitzen und toten Enden | Vegetativer Teil einer Einzelpflanze | Zahlreiche Seitentriebe |
 |
 |
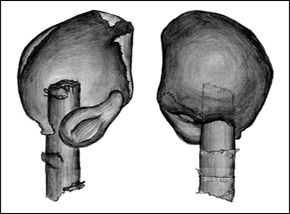 |
| A:
dorsal, oberschlächtige Blättchen B: ventral, Wassersäcke |
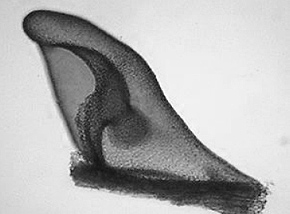
REM-Aufnahme der Ventralseite mit Wassersäcken | Zeichnung einer Blatteinheit bestehend aus Ober- und Unterlappen (Wassersack) |
 |
 |
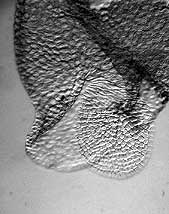 |
| Isolierter Wassersack, lateral |
REM-Aufnahme, Wassersack lateral angeschnitten | Öffnung mit hyalinem Häutchen |
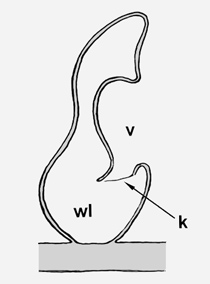 |
Schematische Darstellung eines Wassersacks, längs: v = Vorhof wl = Wassersacklumen k = bewegliche Klappe |
 |
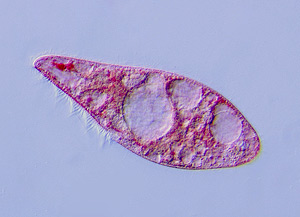 |
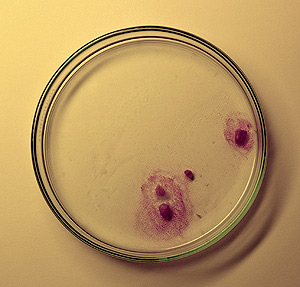
| Kultur von Blepharisma americanum | Blepharisma americanum, Testbeute im Zoophagie-Versuch |
 |
| Die Ciliaten sind in den Wassersäcken von Pleurozia purpurea gefangen |
 |
| Schottland 2004, nahe dem Standort |
 |
 |
 |
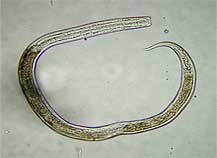 |
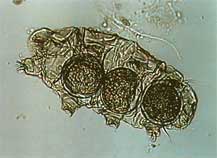
| Milbe in Wassersack gefangen | Copepode aus Wassersack | Bärtierchen aus Wassersack | Nematode aus Wassersack |